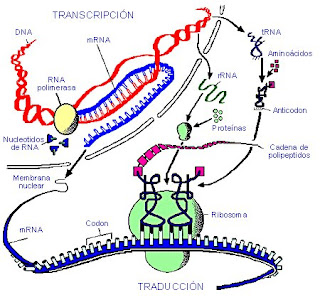

Síntesis proteica
La síntesis de proteínas o traducción del ARN es el proceso anabólico mediante el cual se forman las proteínas a partir de los aminoácidos. Es el paso siguiente a la transcripción del ADN a ARN. Como existen 20 aminoácidos diferentes y sólo hay cuatro nucleótidos en el ARN (Adenina, Uracilo, Citosina y Guanina), es evidente que la relación no puede ser un aminoácido por cada nucleótido, ni tampoco por cada dos nucleótidos, ya que los cuatro tomados de dos en dos, sólo dan dieciséis posibilidades. La colinearidad debe establecerse como mínimo entre cada aminoácido y tripletes de nucleótidos. Como hay sesenta y cuatro tripletes diferentes (combinación de cuatro elementos o nucleótidos tomados de tres en tres con repetición), es obvio que algunos aminoácidos deben tener correspondencia con varios tripletes diferentes. Los tripletes que codifican aminoácidos se denominan codones. La confirmación de esta hipótesis se debe a Nirenbert, Ochoa y Khorana.
En la biosíntesis de proteínas se pueden distinguir las siguientes etapas:
a) Activación de los aminoácidos.
b) Traducción:
Iniciación de la síntesis.
Elongación de la cadena polipeptídica.
Terminación de la síntesis.
c) Asociación de varias cadenas polipeptídicas y a veces de grupos prostésicos para constituir las proteínas.
La síntesis de proteínas o traducción tiene lugar en los ribosomas del citoplasma celular. Los aminoácidos son transportados por el ARN de transferencia (ARNt), específico para cada uno de ellos, y son llevados hasta el ARN mensajero (ARNm), donde se aparean el codón de éste y el anticodón del ARN de transferencia, por complementariedad de bases, y de ésta forma se sitúan en la posición que les corresponde.
Una vez finalizada la síntesis de una proteína, el ARN mensajero queda libre y puede ser leído de nuevo. De hecho, es muy frecuente que antes de que finalice una proteína ya está comenzando otra, con lo cual, una misma molécula de ARN mensajero, está siendo utilizada por varios ribosomas simultáneamente.
Activación de los aminoácidos Los aminoácidos en presencia de la enzima aminoacil-ARNt-sintetasa y de ATP son capaces de unirse a un ARN de transferencia específico y dan lugar a un aminoacil-ARNt, liberándose AMP, fosfato y quedando libre la enzima, que vuelve a actuar.
//
Iniciación de la síntesis de proteínas
Es la primera etapa de la traducción o síntesis de proteínas. El ARNm se une a la subunidad menor de los ribosomas. A éstos se asocia el aminoacil-ARNt, gracias a que el ARNt tiene en una de sus asas un triplete de nucleótidos denominado anticodón, que se asocia al primer triplete codón del ARNm según la complementariedad de las bases. A este grupo de moléculas se une la subunidad ribosómica mayor, formándose el complejo ribosomal o complejo activo. Todos estos procesos están catalizados por los llamados factores de iniciación (FI). El primer triplete o codón que se traduce es generalmente el AUG, que corresponde con el aminoácido metionina en eucariotas. En procariotas es la fenilmetionina.
Elongación de la cadena polipeptídica
El complejo ribosomal posee dos sitios de unión o centros. El centro peptidil o centro P, donde se sitúa el primero aminoacil-ARNt y el centro aceptor de nuevos aminoacil-ARNt o centro A. El radical carboxilo (-COOH) del aminoácido iniciado se une con el radical amino (NH2) del aminoácido siguiente mediante enlace peptídico. Esta unión es catalizada por la enzima peptidil-transferasa. El centro P queda pues ocupado por un ARNt sin aminoácido. El ARNt sin aminoácido sale del ribosoma. Se produce la translocación ribosomal. El dipeptil-ARNt queda ahora en el centro P. Todo ello es catalizado por los factores de elongación (FE) y precisa GTP. Según la terminación del tercer codón, aparece el tercer aminoacil-ARNt y ocupa el centro A. Luego se forma el tripéptido en A y posteriormente el ribosoma realiza su segunda translocación. Estos pasos se pueden repetir múltiples veces, hasta cientos de veces, según el número de aminoácidos que contenga el polipéptido.
Terminación de la síntesis de la cadena polipeptídica
El final de la síntesis se presenta por los llamados tripletes sin sentido, también denominados codones stop. Son tres: UAA, UAG y UGA. No existe ningún ARNt cuyo anticodón sea complementario de ellos y, por lo tanto, la biosíntesis del polipéptido se interrumpe. Indican que la cadena polipeptídica ya ha terminado. Este proceso viene regulado por los factores de liberación, de naturaleza proteica, que se sitúan en el sitio A y hacen que la peptidil-transferasa separe, por hidrólisis, la cadena polipeptídica del ARNt. Un ARNm, si es lo suficientemente largo, puede ser leído o traducido, por varios ribosomas a la vez, uno detrás de otro. Al microscopio electrónico, se observa como un rosario de ribosomas, que se denomina polirribosoma o polisoma.
La síntesis de proteínas o traducción del ARN es el proceso anabólico mediante el cual se forman las proteínas a partir de los aminoácidos. Es el paso siguiente a la transcripción del ADN a ARN. Como existen 20 aminoácidos diferentes y sólo hay cuatro nucleótidos en el ARN (Adenina, Uracilo, Citosina y Guanina), es evidente que la relación no puede ser un aminoácido por cada nucleótido, ni tampoco por cada dos nucleótidos, ya que los cuatro tomados de dos en dos, sólo dan dieciséis posibilidades. La colinearidad debe establecerse como mínimo entre cada aminoácido y tripletes de nucleótidos. Como hay sesenta y cuatro tripletes diferentes (combinación de cuatro elementos o nucleótidos tomados de tres en tres con repetición), es obvio que algunos aminoácidos deben tener correspondencia con varios tripletes diferentes. Los tripletes que codifican aminoácidos se denominan codones. La confirmación de esta hipótesis se debe a Nirenbert, Ochoa y Khorana.
En la biosíntesis de proteínas se pueden distinguir las siguientes etapas:
a) Activación de los aminoácidos.
b) Traducción:
Iniciación de la síntesis.
Elongación de la cadena polipeptídica.
Terminación de la síntesis.
c) Asociación de varias cadenas polipeptídicas y a veces de grupos prostésicos para constituir las proteínas.
La síntesis de proteínas o traducción tiene lugar en los ribosomas del citoplasma celular. Los aminoácidos son transportados por el ARN de transferencia (ARNt), específico para cada uno de ellos, y son llevados hasta el ARN mensajero (ARNm), donde se aparean el codón de éste y el anticodón del ARN de transferencia, por complementariedad de bases, y de ésta forma se sitúan en la posición que les corresponde.
Una vez finalizada la síntesis de una proteína, el ARN mensajero queda libre y puede ser leído de nuevo. De hecho, es muy frecuente que antes de que finalice una proteína ya está comenzando otra, con lo cual, una misma molécula de ARN mensajero, está siendo utilizada por varios ribosomas simultáneamente.
Activación de los aminoácidos Los aminoácidos en presencia de la enzima aminoacil-ARNt-sintetasa y de ATP son capaces de unirse a un ARN de transferencia específico y dan lugar a un aminoacil-ARNt, liberándose AMP, fosfato y quedando libre la enzima, que vuelve a actuar.
//
Iniciación de la síntesis de proteínas
Es la primera etapa de la traducción o síntesis de proteínas. El ARNm se une a la subunidad menor de los ribosomas. A éstos se asocia el aminoacil-ARNt, gracias a que el ARNt tiene en una de sus asas un triplete de nucleótidos denominado anticodón, que se asocia al primer triplete codón del ARNm según la complementariedad de las bases. A este grupo de moléculas se une la subunidad ribosómica mayor, formándose el complejo ribosomal o complejo activo. Todos estos procesos están catalizados por los llamados factores de iniciación (FI). El primer triplete o codón que se traduce es generalmente el AUG, que corresponde con el aminoácido metionina en eucariotas. En procariotas es la fenilmetionina.
Elongación de la cadena polipeptídica
El complejo ribosomal posee dos sitios de unión o centros. El centro peptidil o centro P, donde se sitúa el primero aminoacil-ARNt y el centro aceptor de nuevos aminoacil-ARNt o centro A. El radical carboxilo (-COOH) del aminoácido iniciado se une con el radical amino (NH2) del aminoácido siguiente mediante enlace peptídico. Esta unión es catalizada por la enzima peptidil-transferasa. El centro P queda pues ocupado por un ARNt sin aminoácido. El ARNt sin aminoácido sale del ribosoma. Se produce la translocación ribosomal. El dipeptil-ARNt queda ahora en el centro P. Todo ello es catalizado por los factores de elongación (FE) y precisa GTP. Según la terminación del tercer codón, aparece el tercer aminoacil-ARNt y ocupa el centro A. Luego se forma el tripéptido en A y posteriormente el ribosoma realiza su segunda translocación. Estos pasos se pueden repetir múltiples veces, hasta cientos de veces, según el número de aminoácidos que contenga el polipéptido.
Terminación de la síntesis de la cadena polipeptídica
El final de la síntesis se presenta por los llamados tripletes sin sentido, también denominados codones stop. Son tres: UAA, UAG y UGA. No existe ningún ARNt cuyo anticodón sea complementario de ellos y, por lo tanto, la biosíntesis del polipéptido se interrumpe. Indican que la cadena polipeptídica ya ha terminado. Este proceso viene regulado por los factores de liberación, de naturaleza proteica, que se sitúan en el sitio A y hacen que la peptidil-transferasa separe, por hidrólisis, la cadena polipeptídica del ARNt. Un ARNm, si es lo suficientemente largo, puede ser leído o traducido, por varios ribosomas a la vez, uno detrás de otro. Al microscopio electrónico, se observa como un rosario de ribosomas, que se denomina polirribosoma o polisoma.








